协会服务
Association Services

新修订的《医疗器械监督管理条例》将于2021年6月1日起施行,为帮助企业相关人员学习和理解新修订的《医疗器械监督管理条例》,厦门市医疗器械协会邀请了厦门市市场监督管理局医疗器械安全监督管理处处长:何清杭博士,于2021年4月24日上午举办了一期医疗器械新法规宣贯培训班。


这次培训班空前盛大,来自厦漳泉医疗器械的生产和经营的企业负责人、管理者代表、质量、研发、法规、注册等专业人员共计420余人参加。
下面强哥跟大家一起来分享和小结一下这次培训我的一些心得体会。
一、何博士此次培训,打破了传统的由美国质量管理专家休哈特博士首先提出的PDCA循环管理模式,他结合中国特色,并引用了伟大领袖毛泽东主席在1937年7月延安窑洞里写下的关于马克思主义认识论的代表作《实践论》,并以新版《医疗器械监督管理条例》,阐述了毛主席的实践、认识、再实践、再认识,这种形式循环往复以至无穷,发现、证实和发展真理。

二、根据新版《医疗器械监督管理条例》,何博士总结了“生产18不准”、“经营18不准”、“使用18不准”,由浅入深的向大家说明了新的739号令的概括,让大家能更好的学习新的条例。
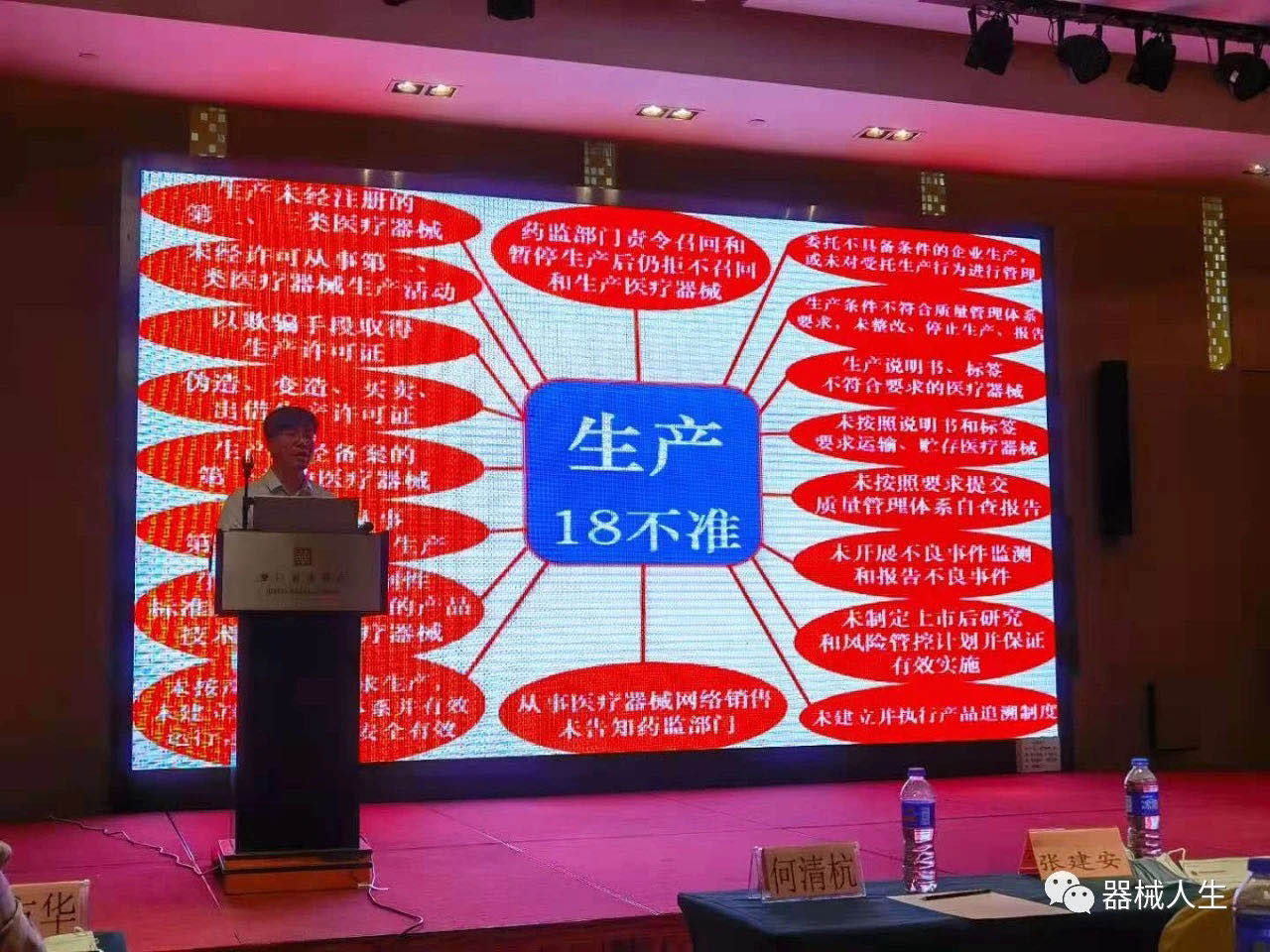


三、透过简明扼要的列表式说明,何博士跟大家分享了新旧《医疗器械监督管理条例》的差异。在这次新版条例当中,比从原来680号令的8章80条,增加了27条,至107条,同时对其中的章节修改了70条。因此,后续各相关专业人员新法规的学习非常有必要。
四、结合了此次新版《医疗器械监督管理条例》,能更好的发现了党中央的“放、管、服”精神。其中涉及到“放”的政策有7条,“管”的政策有17条,“服”的政策有3条。

4.1在“放”的政策中有:
4.1.1 新增注册备案产品自检报告;
4.1.2 新增医疗器械附条件审评制度;
4.1.3 新增医疗器械紧急使用制度;
4.1.4 完善医疗器械临床评价制度;
4.1.5 完善医疗器械临床试验管理制度;
4.1.6 新增医疗器械拓展性临床试验管理制度;
4.1.7 新增临床急需进口少量医疗器械管理制度。
4.2在“管”的政策中有:
4.2.1 新增医疗器械监督管理遵循的基本原则;
4.2.2 新增地方政府医疗器械监管领导责任;
4.2.3 新增医疗器械注册(备案)人及进口代理人义务;
4.2.4 完善医疗器械委托生产制度;
4.2.5 新增医疗器械唯一标识制度;
4.2.6新增医疗器械网络销售管理制度;
4.2.7新增医疗机构研制试剂管理制度;
4.2.8 强化注册人(备案)人医疗器械不良事件监测责任;
4.2.9新增注册人(备案)人开展医疗器械再评价制度;
4.2.10新增职业化专业化医疗器械检查员制度;
4.2.11新增医疗器械延伸检查制度;
4.2.12新增医疗器械企业责任约谈制度;
4.2.13新增医疗器械行政责任约谈制度;
4.2.14完善医疗器械复检制度;
4.2.15增加违法行为处罚到人制度;
4.2.16提高财产惩罚幅度;
4.2.17加大资格惩罚力度。
4.3在“放”的政策中有:
4.3.1 新增鼓励和支持医疗器械创新;
4.3.2 新增医疗器械临床试验伦理审查制度;
4.3.3 新增部分二类医疗器械免于备案制度。
五、将《医疗器械生产监督管理办法》及相关附录,透过雅俗共赏的模式,采用“扑克牌”的管理模式,向大家说明了各个章节的主旨要义及目标。比如:
第一章总则应实现“依规建立,有效运行”的目标;
第二章机构与人员应实现“机构完整,各尽其责”的目标;
第三章厂房与设施应实现“布局合理,满足生产”的目标;
第四章设备应实现“设备完好,运行正常”的目标;
第五章文件管理应实现“做所说的,记所做的”的目标;
第六章设计开发应实现“依法设计,按规开发”的目标;
第七章采购应实现“来源合法,物料合格”的目标;
第八章生产管理应实现“生产规范,过程可控”的目标;
第九章质量控制应实现“按规检验,严格放行”的目标;
第十章销售和售后服务应实现“去向合法,产品合格”的目标;
第十一章不合格品控制应实现“有效隔离,按规处置”的目标;
第十二章不良事件监测、分析和改进应实现“分析改进,持续提高”的目标;
第十三章附则应实现“准入合规,适用合理”的目标。
六、再次结合《实践论》总结了实践、认识、再实践、再认识,这种形式循环往复以至无穷,发现、证实和发展真理。
6.1 实践:落实全生命周期医疗器械法规要求;
6.2 认识:学习全生命周期医疗器械监管法规;
6.3再实践:有效落实医疗器械生产质量管理规范;
6.4 再认识:全生命周期医疗器械质量管理永远在路上;
6.5 发现、证实真理:探索和证实全生命周期医疗器械质量管理规律;
6.6 发展真理:持之以恒完善全生命周期医疗器械质量管理规律。
何博士的这场培训,实在是让人对新版的《医疗器械监督管理条例》有了新的认识,也让医疗器械人对接下来的法规学习,指明了具体的工作思路和方向,感谢何博士的分享。
以上相关素材来源于何博士培训的教材,仅向何博士表示衷心的感谢!

作者:王合强