协会服务
Association Services
医疗器械分类是产品上市前,对产品确定应该要走哪种申请模式的基本条件。强哥从多年来的医疗器械注册管理经验当中,针对自己亲自参与做过的国家(中国、美国、加拿大、欧盟、日本等),通过对国外医疗器械分类管理的主要成功经验的分析与提炼,透过整合了网上资源,小结一些个人的经验和分享,如果有其它意见,可再与本人联系探讨,互相学习。

一、中国
根据中华人民共和国国家食品药品监督管理总局令第15号,《医疗器械分类规则》已经2015年6月3日国家食品药品监督管理总局局务会议审议通过,现予公布,自2016年1月1日起施行。
根据该局令,中国的医疗器械按照风险程度由低到高,管理类别依次分为第一类、第二类和第三类。医疗器械风险程度,应当根据医疗器械的预期目的,通过结构特征、使用形式、使用状态、是否接触人体等因素综合判定。
在该局令当中,针对《医疗器械分类规则》已经做了很详细的介绍了,同时也提供了《医疗器械分类判定表》。
这时候,有人不禁要问,我们的产品到底分在哪个类别,如何得知?
为贯彻实施《医疗器械监督管理条例》和《国务院关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号)的要求,国家食品药品监督管理总局组织修订了《医疗器械分类目录》,现予发布,自2018年8月1日起施行。
如果在这个目录当中没有找到你的产品,那不好意思,你就得重新申请医疗器械分类界定了。申请的界面,强哥也帮你找好了:
http://app.nifdc.org.cn/biaogzx/login.do?formAction=login&systemType=2

二、美国
美国《联邦食品药品化妆品法案》中对医疗器械进行了基于风险的分类。基于为保证器械的安全有效所需的控制级别,将器械分为Ⅰ、Ⅱ、Ⅲ共三类。美国联邦食品药品监督管理局(FDA)将约1700 种医疗器械按16 个医学专业分组建立了分类数据库。每一种医疗器械都根据为保证其安全和有效所需要进行控制的级别而将其归属于这三个法规分类中的一类。这三类及应用于其上的要求如下:
医疗器械分类及法规控制
1) Ⅰ类一般控制
有豁免
无豁免
Ⅱ类一般控制加特殊控制
有豁免
无豁免
Ⅲ类一般控制加上市前批准
医疗器械的分类决定了FDA 市场准入的上市前提交资料/申请的类型。如果器械被分在Ⅰ或Ⅱ类,且不是豁免的器械,则上市前要求一个510(k)。所有被分类为豁免的器械均须遵从豁免的限制性规定。豁免器械的限制性规定包含在21CFR xxx.9,xxx参见Parts 862-892。所有Ⅲ类医疗器械,除非是修正案前的器械(1976 年医疗器械修正案通过前就已经在市场上的器械,或实质等同于一个这样的器械)并且其PMA 从未被要求过,均要求获得上市前批准(PMA)。而那种情况,则上市前需要一个510(k)。
医疗器械的分类取决于器械的预期用途也取决于其适应症。例如,一个外科手术刀的预期用途是切组织。当一个更专门的说明被加入这个器械的标识例如“在眼角膜上切口”则产生了一个预期用途的子集,但也可能在销售这个产品时被口头传达。一个关于预期用途的意义的讨论包含在FDA 官网的链接:PremarketNotificationReview Program K86-3(上市前公告审核程序K86-3)中。
此外,分类是基于风险的,也就是说,器械明示给病人和/或用户的风险是确定分类的主要因素。Ⅰ类包含了风险最低的医疗器械,而Ⅲ类包含了那些风险最大的医疗器械。
如上所述所有的医疗器械均须服从一般控制。一般控制是联邦食品、药品和化妆品(FD&C)法案中对所有医疗器械Ⅰ、Ⅱ、Ⅲ类的基本要求。
如何确定分类呢?
为找到一个器械的分类,以及是否存在豁免,首先要找到法规号也就是这个器械的分类法规。有两种方法来达到这一目的:直接进入FDA 官网链接classification database(分类数据库)用器械名的一部分进行搜索,或,如果你知道这个器械属于哪个device panel(医学专业分组),可以直接进入该分组的清单并识别该器械及其对应的法规。你可以现在做一个选择,或者继续阅读下面的背景信息。如果你继续阅读,你将有另一个机会达到这些目的。
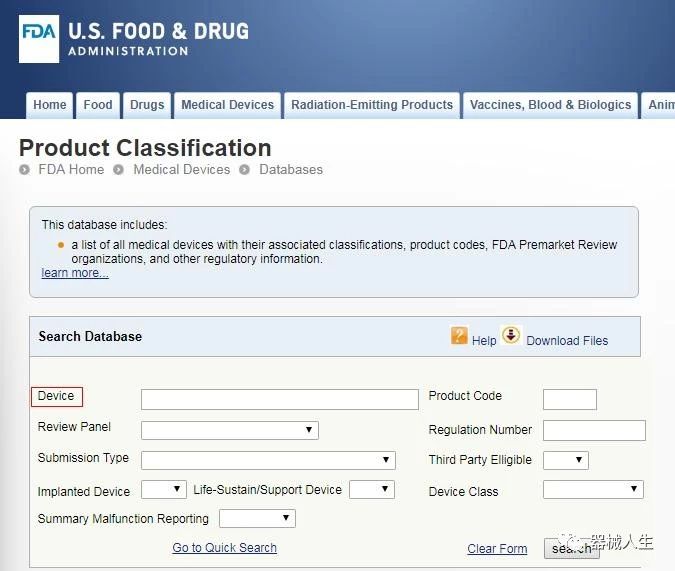
如果你已经知道恰当的专业分组你可以阅读分类器械的清单直接通过CFR 找到该器械的分类,或者如果你不能确定,你可以使用FDA 官网上的链接PRODUCT CODE CLASSIFICATION DATABASE(产品代码分类数据库)中的关键词目录。多数情况这个数据库会在CFR 中确定分类法规。你也可以检查下面的FDA 链接classification regulations(分类法规)来获得不同产品的信息以及他们是如何被CDRH 监管的。
CFR 中的每一个专业分组都是由该组的器械分类清单开始的。每个分类了的器械都有一个与其相关联的7 位数,例如,21 CFR 880.2920 临床水银温度计。一旦你在这个专业分组的开始的清单中找到了你的器械,进入其指示的部分的链接:此例中即21 CFR 880.2920。它描述了这个器械并指明它是Ⅱ类。类似的,在分类数据库“温度计”下面,你可以看到有几个入口分别对应于不同类型的温度计。三个字母的产品代码,在数据库中FLK 对应临床水银温度计,也是在医疗器械列表中使用的分类号。
一旦你确定了正确的分类法规则进入下面的链接What are the Classification Panels(什么是分类专业分组)并点击正确的分类法规或进入链接CFR Search page(CFR 搜索页面)。一些Ⅰ类的器械被豁免上市前公告和/或优良制造规范(GMP)的部分要求。大约572 种或74%的Ⅰ类的器械被豁免上市前公告流程。这些豁免都列入了21CFR 分类法规中并且也汇集在链接Medical DeviceExemptions(医疗器械豁免)的文件中。
三、欧盟
在欧盟的《医疗器械指令(MDD)》中对医疗器械的分类采用基于风险和规则的分类。将医疗器械(除有源植入和体外诊断医疗器械外)按风险由低到高分为Ⅰ、Ⅱa、Ⅱb、Ⅲ共四类。
依据MDD 的第9 条及附录Ⅸ“分类规则”即可确定医疗器械的分类。根据新版的MDR指令,仍然还是如此进行分类。
当制造商与有关公告机构因采用分类规则发生争议的情况下,应将争议提交该公告机构所属的主管当局解决。
当一个欧盟成员考虑附录Ⅸ中提出的分类规则需要根据技术进步和第10 条规定的信息系统进行修改,可以提交给欧盟委员会一个正式的用事实支持的申请要求对分类规则的修改做出必要的评估。针对本指令中分类规则修订的评估为针对非基本要素的修订应采用本指令第7 条第3 款所述的法规程序来进行。
符合欧盟法规要求的,也就是被评定合格的医疗器械在张贴CE 标识后可以在欧盟各成员国上市自由流通。器械的分类决定了其合格评定的程序。所有的医疗器械均必须符合MDD 的附录一中,根据该器械的预期目的所适用的基本要求(Essential Requirements)。任何器械,只要符合欧盟的协调标准,则欧盟成员国就应推定其符合前述的基本要求。
对于风险低的Ⅰ类器械,其合格评定可由制造商单独完成。对于Ⅱa 类器械,公告机构则应在制造阶段强制介入。对于具有较高的潜在风险的Ⅱb 和Ⅲ类,公告机构应对其设计和制造进行检查。而对于风险最高的Ⅲ类器械,在它们投放市场前必须对其合格性作出明确的核准。
虽然在关于医疗器械的指令MDD 中列举了不同的合格评定程序,但近年来,许多制造商都选择全面质量保证的程序,也就是由公告机构首先对其质量体系进行ISO13485 的认证。这个质量体系认证也同时表明了制造商的质量体系符合MDD 附录二第三章的要求,因此公告机构可同时颁发EC 证书。
对于Ⅰ、Ⅱa 和Ⅱb 类产品,应在制造商或其欧洲授权代表处保存技术文件(Technical File)以备政府主管部门或公告机构审查。而对于Ⅲ类医疗器械,制造商还必须将其产品的设计文档(Design Dossier)送交公告机构进行审评,审评通过后由公告机构颁发设计检查证书。Ⅲ类医疗器械只有在获得两张由公告机构颁发的证书:EC 证书+设计检查证书,并由制造商的授权人员签署“符合性声明”后,方可在其产品上张贴CE 标识。
四、加拿大
加拿大对医疗器械的分类与欧盟MDD指令中的分类类似,也采用基于风险和规则的分类。在《医疗器械法规》中将医疗器械按风险由低到高分为Ⅰ、Ⅱ、Ⅲ及Ⅳ共四类,具体分类方法依据该法规中的Schedule 1分类规则。如果医疗器械可以被分入多于一个类别,则其分类归类到高的那个类别。Ⅰ类代表最低风险,Ⅳ类代表最高风险。
Ⅰ类:最低风险器械,例如:伤口护理和非外科侵入器械如物理屏障;
Ⅱ类:低风险器械包括隐形眼镜和大多数外科侵入器械;
Ⅲ类:中等风险器械,例如髋关节植入物,葡萄糖监测器和预期可被身体吸收或预期在身体中停留至少30个连续天的外科侵入器械。
Ⅳ类:高风险器械,例如心脏起搏器和用于诊断、控制或纠正一个心血管中枢系统的缺陷的外科侵入器械。
医疗器械的分类规则不同于体外诊断器械,被分为以下四组:
侵入器械
非侵入器械
有源器械
特殊规则
五、日本
日本的《药事法》中对医疗器械进行了基于风险和目录的分类。基于为保证器械的安全有效所需的控制级别,将器械根据其风险由低到高分为一般医疗器械、受控医疗器械和高度受控医疗器械共三类。在日本厚生劳动省的官方网站上,公布了医疗器械的分类目录。
所有制造及上市医疗器械的企业均需获得经营医疗器械的许可证。一般医疗器械(Generalmedical device)不需要上市批准,其销售也不受管制。目前厚生劳动省公布的有1195 种医疗器械属于一般医疗器械。
受控医疗器械 (Controlled medical device)须由经日本政府认可的合格的第三方组织,如TUV PS 等机构进行审评。作为政府主管部门,厚生劳动省利用国际指导原则和标准,建立第三方的资格标准。此类标准包括那些来自国际标准化组织和国际电工委员会的标准。厚生劳动省将定期审核所有第三方组织。目前厚生劳动省公布的受控医疗器械有1786 种。
所有的高度受控医疗器械 (Special controlled medical device)产品的上市前批准申请则由PMDA 负责审查,其审查旨在保障医疗器械产品的质量、安全性和有效性。2004 年4 月,为准备实施修订后的《药事法》,药品和医疗器械审评中心(PMDEC)、日本医疗器械促进协会(JAAME)以及药品安全性和研究机构(OPSR)进行了合并。此次合并形成了一个统一管理药品、生物制品及医疗器械的机构,即药品与医疗器械审批机构(PMDA)。PMDA 是一个独立的管理机构。PMDA 还负责收集并分析关于有缺陷医疗器械产品的相关报告。这一新建立的机构同时也将负责制定审查医疗器械产品的标准。另外,该机构将为药品、生物制品及医疗器械产品公司在设计临床方案方面提供咨询服务。目前厚生劳动省公布的高度受控医疗器械共有1073 种。
六、对比表
各国医疗器械分类对比
国别 风险 | 中国 | 美国 | 欧盟 | 加拿大 | 日本 |
低 高 | 一类 二类 三类 | Ⅰ类 Ⅱ类 Ⅲ类 | Ⅰ类 Ⅱa 类 Ⅱb 类 Ⅲ类 | Ⅰ类 Ⅱ类 Ⅲ类 Ⅳ类 | 1、一般医疗器械 2、受控医疗器械 3、高度受控医疗器械 |
备注:上表中,各国家和地区对于医疗器械分类的级别并不是一一对应。
在美国,联邦食品药品监督管理局建立和维护医疗器械的分类数据库,医疗器械的分类可以依据其上市后的应用及不良事件的情况进行调整。例如,电动牙刷,在美国的属于I类医疗器械,而在中国,则不是医疗器械。
欧盟的医疗器械分类是完全依据分类规则,所有的医疗器械厂商只需要参照欧盟的《医疗器械指令》中的分类规则就可以对医疗器械自行分类。同样大量在欧盟属于Ⅱb或Ⅱa 类的医疗器械,例如,上面提到的诊断用X 线机、彩超等等,在中国被列为三类医疗器械进行监管。日本的医疗器械分类采用分类目录的形式,完全借鉴美国的分类方式,在此不再与其进行对比。而加拿大的医疗器械分类方式则是借鉴了欧盟的分类规则的方式,这也是GHTF 文件中所借鉴的方式。