2017年,中共中央办公厅和国务院办公厅印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,其中要求完善医疗器械注册审评项目管理人制度。笔者比较了美国、欧盟审评机构对项目管理的组织结构设计,验证了不同组织结构对我国审评机构的适用性,认为以专业为导向、兼顾效率的组织结构更加适用于我国。
美国、欧盟模式
要讨论医疗器械注册审评项目管理人制度,首先要了解一个概念——组织结构。组织结构主要有三种,分别是直线职能制、事业部制和矩阵式组织。直线职能制是按专业划分审评部门,事业部制是把存在联系但专业不同的岗位放在一个业务部门,矩阵式组织则保留了专业化管理和事业部管理两条轴线。
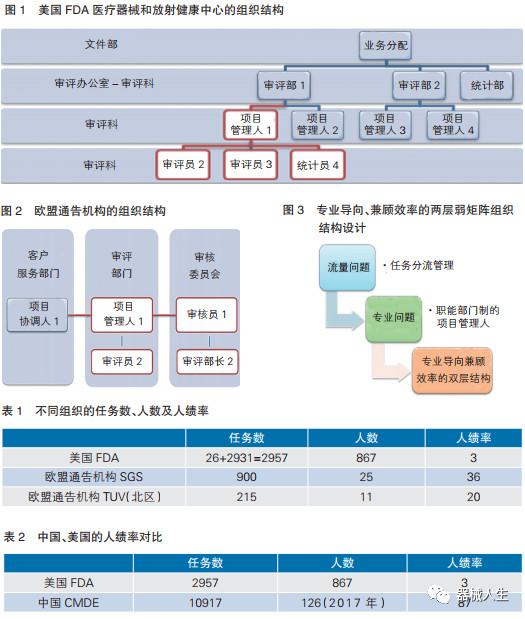
美国食品药品管理局(FDA)采取的项目管理人制度是偏重直线职能制的弱矩阵式组织结构:项目管理人设在部门,常规的业务如510k(上市前通知)采取直线职能制;对PMA(上市前审批)等项目采取矩阵式,组成项目组的过程抽调统计学部门的人员。但在审评意见的决策过程中,每一个审评员的专业意见都是向上沟通,例如统计专员在给出最终统计学意见时经统计部门负责人审核。如图1所示,业务分配至审评部1,由部长指派到项目管理人1;项目管理人1立项,根据项目情况组建审评小组(项目管理人1、审评员2、审评员3、统计员4)。
相较于美国FDA,欧盟的通告机构采取的项目管理人制度是强矩阵式组织结构(见图2):项目协调人设在客户服务部门,在接收任务后分配给具有资质及空档的项目管理人。之所以强调这种组织结构的项目协调人,在于项目管理人1和审评员2都是由项目协调人1遴选和组织的,因此这种组织结构的任务管理轴线是横向的,审评小组的组成也是横向的,强调资源的充分分配和调度而不是部门的专业性。欧盟通告机构的组织结构还有一个显著特点,就是审评意见的最终审核由独立的审核部门做出,而不是业务职能部门的部长或负责人完成,进一步体现了任务的横向管理轴线,并且将任务的分配(项目协调人)、管理(项目管理人)和审核(项目审核人)分开,体现了授权分治原则。总体来说,欧盟通告机构的组织结构强调的是效率为导向的强矩阵式结构。
国外经验分析
美国和欧盟的项目管理人制度孰优孰劣呢?答案是各有利弊。造成两者组织结构差异的一个重要原因,源于组织是专业导向还是效率导向。
美国FDA是政府部门,其组织目标首先是社会责任,即保障上市产品的安全和有效,其组织的边界是审评时限,而不是成本收益。因此美国FDA可以招募更多专业人员完成审评工作,其导向必然是专业。与此相对,欧盟的通告机构是商业部门,组织目标首先是客户和发展,其组织的边界是成本收益,因此通告机构不会招募更多的人员,而是充分利用已有的资源完成预期工作,其导向就是效率。
上述假设,可以从不同组织的任务数、人数及人绩率来加以验证(见表1)。
如果我们采用欧盟的管理模式,最大的问题源于专业性的考虑:由于医疗器械涉及众多学科,如果项目管理人不是资深审评员,他难以带领团队完成专业的审评业务;如果项目管理人是资深审评员,抽调所有资深审评员到项目管理部,审评部门就会缺少骨干而发展缓慢,这一问题在大量新入职审评员迫切需要指导的情况下显得更为突出。
那么,能否直接采用美国的专业化项目管理人模式呢?回答这个问题要考虑我国医疗器械技术审评中心(CMDE)的人员现状。即使CMDE的人员可以扩增到300人,与美国FDA也存在非常大的差距(见表2),因此效率也是我们在组织设计上不得不考虑的目标。所以,在短期内不能直接采用美国的项目管理人模式。客观需要决定了中国必须走出自己的路,设计出自己的项目管理人制度。
寻找中国答案
组织结构设计,能不能兼顾专业和效率呢?从前文的组织结构理论和美国、欧盟的实践经验看,效率的实现在组织结构层面依靠的是事业部制,在实践层面依靠的是水平的任务管理轴线,但是这个方法应用的前提是任务的同质性。只有同质性较好的任务才能通过事业部制和水平管理轴线提高效率。在全部的医疗器械注册审评工作中,延续注册显然是这样的任务,部分简单的变更也可以考虑,但是首次注册和复杂的变更必须排除在外。
组织结构设计的第一步是建立一个效率型事业部,从而解决流量问题。例如,采取分流管理技术,设立部门负责同质化的注册申请,采用水平管理轴线。
实施项目任务管理的工作可以定义为“分流管理”。分流管理工作的任务就是根据不同类型的申请,按照分类原则进行分类,按照分类结果进行分流,走不同的审查流程和部门。遵循工作任务整合的原则,分流管理可以由受理部门接收资料后直接进行。从这个角度看,分流管理是对现有流程的再设计,其目的是产生最佳流程——能以最低的成本和最小的投入稳定地生产出最多样的服务。
可以建立负责简单项目的部门,如项目管理部。在组织结构的选择上可采取垂直管理轴线,对任务进行分类处理。
项目管理人的职责是调配项目管理部中的审评员资源,立项和安排任务给审评员,跟进任务进度,与申请人沟通,以及任务完成后的归档和数据汇报。
组织结构设计的第二步是各审评部的项目管理人,这时就要重点考虑任务的专业性,可以采取专业导向的弱矩阵结构。
这样我们就设计了一个专业导向、兼顾效率的两层弱矩阵组织结构。第一层组织结构采取事业部制的水平任务管理轴线;第二层采取弱矩阵结构的垂直管理轴线(见图3)。
需要提醒的是,组织结构是项目管理人的关键基础,但是每个项目管理人都是独立的个体,要在团队合作的关系下工作,也要与其他部门或项目团队产生协作,所以项目管理人制度的设计还包括向上汇报、向下指导以及平行合作,包括任职的基本要求和职业发展规划,也包括保障项目管理人可以获得必要的资源做好其工作等。
总之,管理绝非仅是被动适应,而是隐含了一种企图塑造内部环境的责任,在变动中主动规划、开创和突破难关的责任,以及不断铲除外部
环境对组织活动限制的责任。医疗器械项目管理人制度是在医疗器械审评审批体制改革的背景下提出的,也是目前我们面临的最核心的紧急任务之一。(本文选编自《中国食品药品监管》杂志2019年第1期,作者:李非,系辽宁省医疗器械检验检测院副院长)
来源:中国医药报