随着国内外经济形势的变化、2018年我国部委改革的推进,2019年各大行业政策也要与时俱进地作相应的调整。
本文对关注度最高的化学仿制药、肿瘤药和辅助用药三大类产品进行分析,对影响其发展较大的政策趋势作剖析,并预测相关企业的发展趋势。
A 化学仿制药
“政策细调年”诸多看点
[看点] 原料药制剂生产一体化企业将布局大规模品种
咸达数据V3.5发现,2018年仿制药申报恢复活跃,其中新3类申报129个受理号,新4类申报413个受理号,为近三年新高。恩替卡韦片、富马酸替诺福韦二吡呋酯片和替格瑞洛片是最多厂家申报的产品,都有9个生产厂家申报。
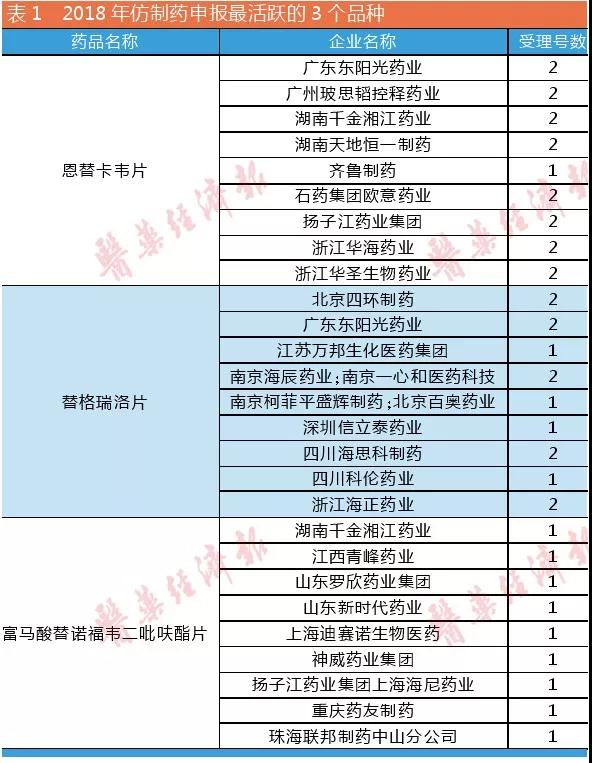
恩替卡韦片和富马酸替诺福韦二吡呋酯片是“4+7”目录的产品,价格在0.65元/片左右。因此,“4+7”又可能遏制化学仿制药扎堆情况,中小企业立项会越来越谨慎。规模大的化学药仿制药将是原料药制剂生产一体化企业竞争布局的方向。
2019年,通过一致性评价的产品还会增加,预计注射剂通过的产品会越来越多,特别是销售排名前列的注射剂目前都已有企业布局,预计二甲双胍普通片及缓释片等将成为“4+7”目录的新增产品。
[看点] 或以招标采购的准入政策限制,促其启动一致性评价
需要在2018年年底完成一致性评价的289个产品的年限限制已经放开。这一方面意味着没有企业启动一致性评价的对应产品的生产批文都保住了;另一方面,对于改剂型改规格的独家产品而言,完全没有了启动一致性评价的动力,此类产品不符合国内新注册分类要求,因而未来难有新的挑战者上市,从而使得已上市厂家有望长期拥有独家剂型的价格独占优势。
2018年下半年,医保局作为支付方管理招标采购,“4+7”针对通过一致性评价产品的带量采购,低于市场预期的中标价结果,触发各相关上市企业股价一跌再跌。参考全球的药品价格和全国医院销量,并与一致性评价项目费用作比较后,可以得到年投资回报情况,并以此作为是否开展一致性评价的判定标准。专利到期的仿制药鼓励清单预计将在2019年年中公布,然而,如果满足不了上述盈利条件,预计政策将无人响应。
因此,招标采购的准入政策成为企业是否开展一致性评价的动力。为了提高独家剂型产品参与一致性评价的积极性,可以考虑对市场销售额排名前列的独家剂型品种的化学仿制药或改良药出一个“不通过一致性评价不得参与医疗机构采购的目录”规定;如果同通用名医保剂型同类通过一致性评价的产品通过3家,那么不同酸根不同盐的相关剂型产品都不得进入医疗机构的采购,以进一步刺激企业启动一致性评价。
[看点] 放开进口短缺原料药?“原辅包”细节调整?
原料药主要是环评问题和垄断问题。从生态环境和产业布局考虑出发,国家有可能定点几个原料药工业园区和环评标准,积极鼓励高利润价值的原料药CDMO业务。并且,对于一些紧缺的、市场规模大的原料有可能允许国外进口中间体或原料药。
原料辅料包材(简称“原辅包”)的备案制度期望在2019年正式执行,且收费标准得以公布。对于一些只是提高国内企业成本,国外企业有可能拒绝执行而拒绝进口的政策,相关政策要求或能降低到世界平均水平。
[看点] 质量标准冲突问题、数据保护政策、进口仿制药地产化
由于部门政策不同导致的政策冲突有望2019年逐步解决。特别是加入ICH后,相关政策预计会在2019年陆续颁布并制定执行期限。质量标准方面,2020年版中国药典即将发行,个别一致性评价要求与国内质量标准冲突的产品,有待负责质量标准的部门做最终确定与核实。
首仿药方面,数据保护政策何时落地,是与其它仿制药建立上市时间差的关键。然而国内的招标采购政策对于首仿药的配套只是通过一致性评价的仿制药直接挂网政策,还需要逐个省份去开展工作。
从产业分工的成熟度看,仿制药在我国以药品上市许可持有人制度进行竞争优势有限,2019年更多的是投资过热的制剂生产面临整合,进口仿制药地产化项目进入执行落地阶段。
B 肿瘤药
最多利好也有“大考”
聚焦PD-1/PD-L1、单抗类似药
无论是化学药还是生物药,肿瘤药都是新药最集中攻克的领域。预计2019年进口新药潮中能够减免临床有条件获批上市的依然是肿瘤新药。
最值得关注的是——PD-1/PD-L1的新药在2019年会再获批几个?哪个PD-1/PD-L1将进入2019年医保谈判并进入医保目录?
2019年肿瘤药获批值得关注的还有专利到期的单抗类似药——国内会有多少单抗类似药生产厂家获批?获批之后会对现有的价格体系造成怎样的影响?
地方如何让肿瘤药降价到位?
2019年将是抗肿瘤药减税后的降价到位执行年。2018年4月,为鼓励抗癌药产业发展、降低患者用药成本,财政部主动对抗癌药减税:自2018年5月1日起,增值税一般纳税人生产销售和批发、零售抗癌药品,可选择按照简易办法依照3%征收率计算缴纳增值税,36个月内不得变更。并且,自2018年5月1日起,对进口抗癌药品,减按3%征收进口环节增值税。
辽宁2018年12月10日公示了共有69个药品生产企业的203个药品主动申请降价,有2个药品生产企业的2个药品申请不降价、但提供了会计事务所证明材料,有10个药品生产企业的14个药品自述不受降税影响申请不降价、亦未提供会计事务所相关证明材料,有43个药品生产企业的70个药品末递交任何材料。对于主动申请降价的药品、申请不降价已提供会计事务所证明的药品无异议的,将直接在辽宁省采购平台进行价格调整。
公示后自述不受降税影响申请不降价亦未提供会计事务所相关证明材料的2个药品、降幅未达到要求的57个药品、未做出任何响应的66个药品暂停采购。2018年12月29日,21个药品生产企业的42个国产抗癌药品降税降价后申请挂网恢复成功。
辽宁只是第一个省份,海南省《关于抗癌药物降价问题处理的通知》中提到了国家医保局公布了《103个降税药品的未降价抗癌药(13个)品种》和《103个抗癌药品中除谈判药外的抗癌药品降价情况统计》。参考海南的处理办法可推测其它省份也将要求《103个降税药品的未降价抗癌药(13个)品种》提交降价申请或未享受税率减免的审计证明,否则撤网;103个抗癌药品中除谈判药外的抗癌药品高于中位价的药品则要申请降价,未提交降价申请的品种将予以撤网。
大考立项和临床设计能力
按适应症建立医保支付标准最有可能实施的就是肿瘤药,特别是现在肿瘤药的适应症都是按指南地位获批的。这意味着各大药企在研发相关适应症的新药前,要研究目前获批的产品医保支付参考价格和竞争程度。若想让国内的新药走向国际化,临床研究设计应不仅仅要立足于通过CDE技术审评的最低要求为目标,而是应该挖掘新药的临床特点,这或许可以从PD-1/PD-L1走出国门开始期待。
C 辅助用药
“连环拳”下焉有剩者?
2018年底国家卫建委发文开展辅助用药目录征集,预计2019年会出国家级目录,目录上很可能会出现销售额排名前列的中药注射剂、生化药和营养用药。2019年会否针对辅助用药出现全国集中采购,并出台相关的医保报销标准,影响着相关企业的存亡。
2018年国家药监局对多个中药注射剂的说明书进行修订,对“禁忌”和“不良反应”等内容修改后,中成药注射剂的用药范围受到限制。预计2019年仍会有不少药品的适应症、用药范围受到进一步限制。
从2018年CDE药物临床试验登记与信息公示平台所公开的信息来看,2018年启动临床有效性试验的辅助用药非常少,脑卒中适应症基本没有注射剂上市后再评价的临床试验启动。神经保护剂在缓解肿瘤药细胞毒制剂所致神经毒性的临床观察,或许可为此类辅助用药打开新的局面。
辅助用药大多数是代理制营销模式,受2018年全面推开“两票制”影响,不少企业出现了兑现CSO营销推广费用不及时的现象,合规营销体系将是辅助用药企业2019年必须攻克的难关,否则大规模的CSO企业将面临资金链断裂,CSO模式难以持续。
《医药代表备案管理办法(试行)》也会在2019年全国遍地开花。药品生产企业(上市许可持有人)公开其医药代表的备案信息,对医药代表加强相关的法律法规、职业道德、专业知识等方面的培训,会成为CSO绩效管理和费用支出的关键指标。
值得注意的是,对于利用医药代表身份参与产品销售、药品统方、处理票款、商业贿赂、提供捐赠、误导用药、歪曲疗效、隐匿不良信息等行为,医药代表将会列入“黑名单”并上报相关管理部门。对所属医药代表违规情况严重的医药企业,将会面临政府多部门联合惩戒,形成一处失信、寸步难行的局面。
“带金推广”模式下“营销为王”的年代终究会成为过去。2019年,所有找到方向的企业,会进入执行期;而找不到方向的企业或者找到方向但不愿意投入的企业,会一直迷茫。在医保局作为强势支付方的年代,能参与全球化竞争,或能“物美价廉”解决医保需求的药品治疗方案的企业,更有未来。
■编辑 余如瑾