2018年12月21日,国家市场监督管理总局(以下简称“总局”)令第2号公布了《市场监督管理行政处罚程序暂行规定》(以下简称《程序规定》),自2019年4月1日起施行。《程序规定》的发布,统一了原工商、质检、食药、知识产权等领域处罚程序,解决了多个处罚程序分立给执法人员带来的困扰。根据个人理解,对此进行全面解读,供执法人员在行政处罚实践中参考。
一、制定背景
党的十九届三中全会审议通过了《中共中央关于深化党和国家机构改革的决定》,决定改革市场监管体制,整合监管职能,深化行政执法体制改革,相对集中行政处罚权,整合精简执法队伍,解决多头多层重复执法问题。新组建的市场监管总局整合了原工商总局、质检总局和食药监总局的职责,以及发改委的价格监督检查与反垄断执法职责,商务部的经营者集中反垄断执法以及国务院反垄断委员会办公室等职责。统一和规范市场监管部门行政处罚程序,对于落实党中央国务院决策部署,确保改革在法治的轨道上运行具有重要意义。
《行政处罚法》出台后,原工商、质检、食药监、价监等部门都制定了相应的行政处罚程序规定,对于规范行政处罚行为,提高行政处罚案件办理质量,促进依法行政,保护公民、法人和其他组织合法权益起到了重要作用。但是,随着市场监管体制改革和行政执法体制改革的深入,特别是今年以来市场监管机构改革力度的加大,执法队伍的整合与各领域执法程序、执法规则、执法文书等不统一的矛盾日益突出,监管人员往往要成为“全能战士”,需要熟悉各条线不同执法要求,在一定程度上制约了行政执法行为的规范化。各级市场监管部门组建完成后,统一和规范市场监督管理行政处罚程序成为亟待解决的首要问题。2号令的出台适应了市场监管体制改革,改变了条线区隔、程序分立局面。
二、制定过程
市场监管总局将《程序规定》作为改革急需推进的立法项目率先启动。在起草过程中,法规司对原工商、质检、食药监、价监等部门行政处罚程序规定进行了认真研究吸收,并分别征求了国家药品监督管理局、国家知识产权局、总局相关司局和地方工商、质检、食药监等市场监管部门意见,在对收集到的意见逐条研究论证,充分采纳合理意见的基础上,进行了修改完善。
为充分了解基层执法实践,确保科学立法、民主立法、依法立法,法规司先后召开两次立法座谈会,分别听取省级、副省级和市、县两级市场监管部门的意见建议;组织召开专题论证会,邀请总局相关司局和省级市场监管部门网监机构负责人对有关电子商务、互联网广告等违法行为行政处罚程序相关规定进行论证。2018年11月5日至12月5日,将征求意见稿向社会公众公布。在对各方面意见进行认真研究吸收的基础上,进一步修改完善,形成了草案,经市场监管总局局务会审议通过,并于12月21日公布,自2019年4月1日起施行。
三、总体结构说明
《程序规定》正文部分共11280字,共79条,分为七章,分别是:第一章 总则;第二章管辖;第三章 行政处罚的一般程序;第四章 行政处罚的简易程序;第五章 执行与结案;第六章 期间、送达;第七章 附则。从总体上吸纳了原相关部门处罚程序的优点,更加注重可操作性,特别是在管辖、办案时限、送达等方面做了一定突破。但总体上看对于一些目前争议较大的问题,还有待未来进一步完善。有关内容及笔者观点在后文逐条解读中进行了阐述。需要说明的问题:
一是关于规章名称。命名为《市场监督管理行政处罚程序暂行规定》,是考虑到机构整合前,原工商、质检、食药监和价监等部门的执法模式自成体系,且运行多年,各方需要较长时间的磨合才能达成共识,目前《程序规定》确立的主要制度和措施还需在机构整合后的执法实践中进行检验。此外,《行政处罚法》的修订已列入十三届全国人大立法规划,故《程序规定》命名为暂行规定、暂行办法,待条件成熟后再行修改完善,取消“暂行”二字。
二是《程序规定》的适用范围。适用于各级市场监管部门、国务院药品监督管理部门和省级药品监督管理部门以及法律、法规授权的履行市场监督管理职能的组织。考虑到反垄断执法行为的特殊性,相关领域的行政处罚程序规定另行制定,不适用《程序规定》。
三是关于总局管理的两个国家局是否适用问题。知识产权部门的执法职能已全部划转至市场监管部门,涉及知识产权领域的行政处罚事项无须特别说明,当然适用《程序规定》。国家药品监督管理局和省级药品监督管理部门承担了一部分行政处罚职能,但上述领域行政处罚程序除级别管辖外,与市场监管领域一般处罚事项相比不具有明显特殊性,单独制定程序规定必要性不大且在立法体例上难以协调。为保障市场监管领域行政处罚程序的统一权威,《程序规定》明确适用于国家药品监督管理部门和省级药品监督管理部门。但这并不意味着这两个部门今后要以市场监管局名义委托执法,因为这两个部门属于相对独立的部门,立法体系上也都直接对其作为执法主体进行了规定,不涉及委托执法或法律法规授权执法问题。所以尽管适用统一处罚程序,但文书应加盖本机关印章。
四是从总体结构上没有按照行政处罚法的体例把听证程序作为单独章节表述。主要考虑听证程序实际是一般程序中对当事人处罚较重(责令停产停业、吊销许可证照、撤销批准证明文件、较大数额罚款、没收较大数额非法财物)情形下的听取当事人意见的特殊环节,从本质上仍然属于一般程序范畴。
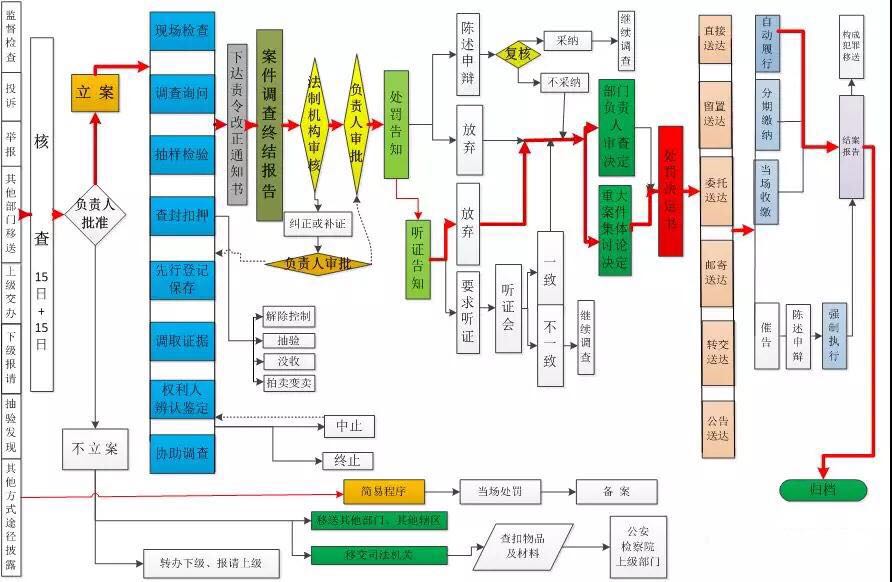
四、处罚流程图
截至目前,不论是原工商、质检、食药监,还是市场监管总局,均尚未发布过官方版行政处罚程序流程图。下图为笔者结合对《程序规定》的理解,为方便执法人员学习而绘制的参考图。
后续内容敬请继续关注本公众号,每天陆续连载。