

2019年5月31日,国家药品监督管理局发布了《2018年度医疗器械注册工作报告》,继续为公众提供权威、准确的监管数据。现摘录其中精华以飨读者!
一、医疗器械注册工作情况
1、发布《眼科超声诊断设备注册技术审查指导原则》等53项医疗器械技术审查指导原则,提升各级药品监管部门审查水平,统一审查尺度。
2、发布新修订免于进行临床试验医疗器械目录,对共计1254类产品免于进行临床试验。
3、批准骨科手术机器人等21个创新医疗器械上市,降低临床治疗成本。
4、批准风疹病毒IgG抗体检测试剂(荧光免疫层析法)等5个优先审批产品上市。
5、审核发布医疗器械行业标准104项,医疗器械国家标准10项。开展99项医疗器械行业标准的制修订,申报国家标准制修订项目6项。
6、截至2018年底,我国现行有效医疗器械标准共1618项,其中国家标准219项、行业标准1399项。标准体系的覆盖面、系统性逐年提升,医疗器械标准与国际标准一致性程度已达90%以上。
7、2018年6月和11月,开展2批医疗器械临床试验监督检查,对胶囊内窥镜系统等20个在审注册申请项目的临床试验数据真实性和合规性开展现场检查。发布《医疗器械临床试验检查要点和判定原则》。发布《冠状动脉药物洗脱支架临床前研究指导原则》等5项临床试验指导原则。
8、截至2018年底,全国已有676家临床试验机构备案。
二、医疗器械注册申请受理情况
2018年,国家药品监督管理局依职责共受理医疗器械首次注册、延续注册和许可事项变更注册申请6608项,与2017年相比注册受理项目减少3.3%。
(一)整体情况
受理境内第三类医疗器械注册申请2382项,受理进口医疗器械注册申请4226项。
按注册品种区分,医疗器械注册申请4529项,体外诊断试剂注册申请2079项。
按注册形式区分,首次注册申请1657项,占全部医疗器械注册申请的25.1%;延续注册申请2806项,占全部医疗器械注册申请的42.5%;许可事项变更注册申请2145项,占全部医疗器械注册申请的32.5%。注册形式比例情况见图1。
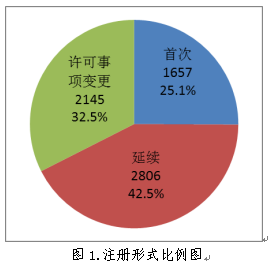
(二)分项情况
1.境内第三类医疗器械注册受理情况
境内第三类医疗器械注册受理共2382项,与2017年相比减少3.1%。其中,医疗器械注册申请1565项,体外诊断试剂注册申请817项。
从注册形式看,首次注册975项,占全部境内第三类医疗器械注册申请数量的41.0%;延续注册799项,占全部境内第三类医疗器械注册申请数量的33.5%;许可事项变更608项,占全部境内第三类医疗器械注册申请数量的25.5%。注册形式分布情况见图2。
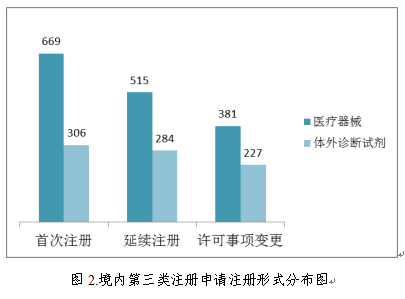
2.进口第二类医疗器械注册受理情况
进口第二类医疗器械注册受理共2125项,与2017年相比增加3.3%。其中医疗器械注册申请1144项,体外诊断试剂注册申请981项。
从注册形式看,首次注册388项,占全部进口第二类医疗器械注册申请数量的18.3%;延续注册1001项,占全部进口第二类医疗器械注册申请数量的47.1%;许可事项变更736项,占全部进口第二类医疗器械注册申请数量的34.6%。注册形式分布情况见图3。
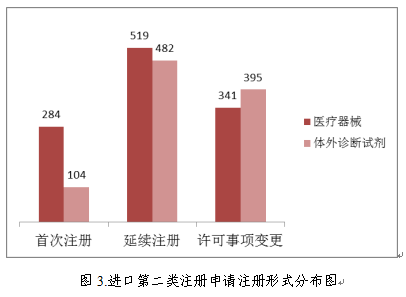
3.进口第三类医疗器械注册受理情况
进口第三类医疗器械注册受理共2101项,与2017年相比减少9.4%。其中医疗器械注册申请1820项,体外诊断试剂注册申请281项。
从注册形式看,首次注册294项,占全部进口第三类医疗器械注册申请数量的14.0%;延续注册1006项,占全部进口第三类医疗器械注册申请数量的47.9%;许可事项变更801项,占全部进口第三类医疗器械注册申请数量的38.1%。注册形式分布情况见图4。
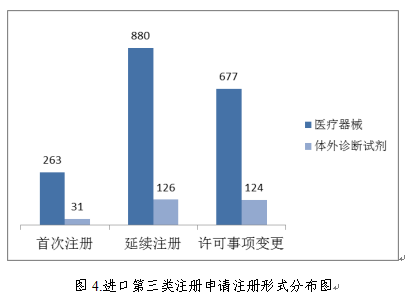
三、医疗器械注册审批情况
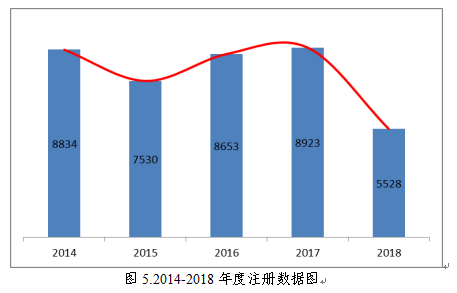
2018年,国家药品监督管理局共批准医疗器械首次注册、延续注册和变更注册5528项。与2017年相比注册批准总数量减少38.0%。其中,首次注册 1128项,延续注册2150项,许可事项变更2250项。
2018年,国家药品监督管理局共对118项医疗器械注册申请不予注册,企业自行撤回238项。
近五年国家药品监督管理局批准医疗器械注册情况见图5。
(一)整体情况
2018年,国家药品监督管理局批准境内第三类医疗器械注册1709项,与2017年相比减少48.2%,进口医疗器械3819项,与2017年相比减少32.1%。
按照注册品种区分,医疗器械3734项,占全部医疗器械注册数量的67.5%;体外诊断试剂1794项,占全部医疗器械注册数量的32.5%。
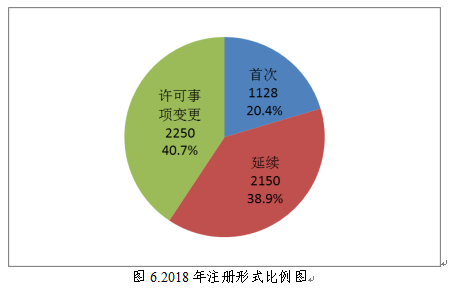
按照注册形式区分,首次注册1128项,占全部医疗器械注册数量的20.4%;延续注册2150项,占全部医疗器械注册数量的38.9%;许可事项变更注册2250项,占全部医疗器械注册数量的40.7%。注册形式比例情况见图6。
(二)分项情况
1.境内第三类医疗器械注册审批情况
境内第三类医疗器械注册1709项。其中,医疗器械1194项,体外诊断试剂515项。
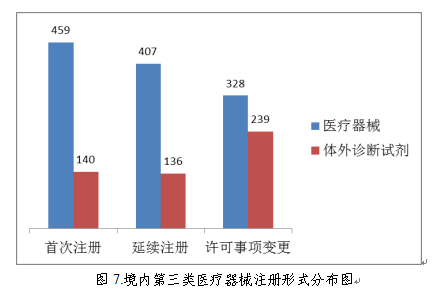
从注册形式看,首次注册599项,占全部境内第三类医疗器械注册数量的35.0%,延续注册543项,占全部境内第三类医疗器械注册数量的31.8%;许可事项变更注册567项,占全部境内第三类医疗器械注册数量的33.2%。注册形式分布情况见图7。
2.进口第二类医疗器械注册审批情况
进口第二类医疗器械注册1992项。其中,医疗器械注册1088项,体外诊断试剂注册904项。
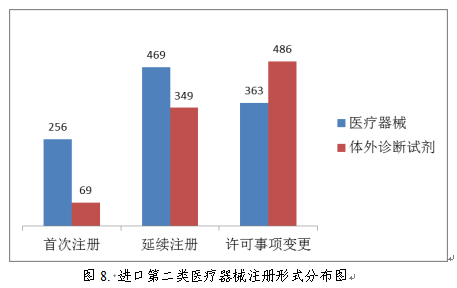
从注册形式看,首次注册325项,占全部进口第二类医疗器械注册数量的16.3%;延续注册818项,占全部进口第二类医疗器械注册数量的41.1%;许可事项变更注册849项,占全部进口第二类医疗器械注册数量的42.6%。注册形式分布情况见图8。
3.进口第三类医疗器械注册审批情况
进口第三类医疗器械注册1827项。其中,医疗器械注册1452项,体外诊断试剂注册375项。
从注册形式看,首次注册204项,占全部进口第三类医疗器械注册数量的11.2%;延续注册789项,占全部进口第三类医疗器械注册数量的43.2%;许可事项变更注册834项,占全部进口第三类医疗器械注册数量的45.6%。注册形式分布情况见图9。
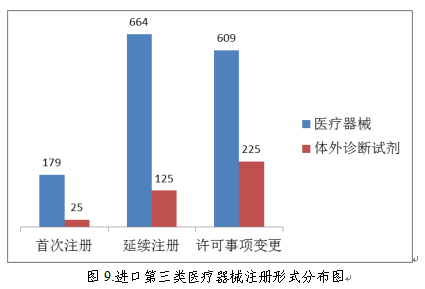
(三)首次注册项目月度审批情况
2018年,国家药品监督管理局共批准医疗器械首次注册1128项,月度审批情况见图10。
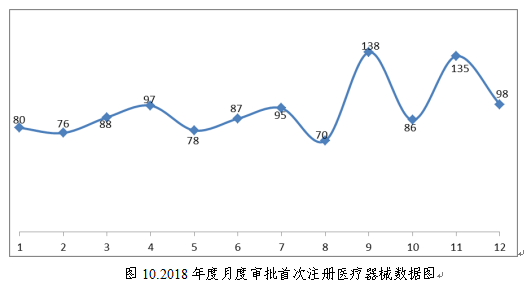
(四)具体批准品种种类分析
2018年8月1日新版《医疗器械分类目录》实施以后,注册的境内第三类医疗器械,除体外诊断试剂外,共涉及《医疗器械分类目录》中17个子目录的产品。
注册数量前五位的境内第三类医疗器械是:无源植入器械,注输、护理和防护器械,医用成像器械,患者承载器械,神经和心血管手术器械。
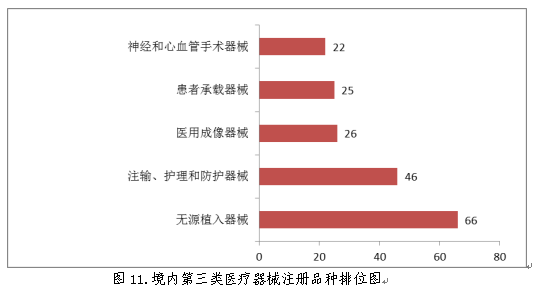
2018年8月1日新版《医疗器械分类目录》实施以后,注册的进口医疗器械,除体外诊断试剂外,共涉及《医疗器械分类目录》中19个子目录的产品。
注册数量前五位的进口医疗器械,主要是:医用成像器械,临床检验器械,无源植入器械,医用诊察和监护器械,口腔科器械。
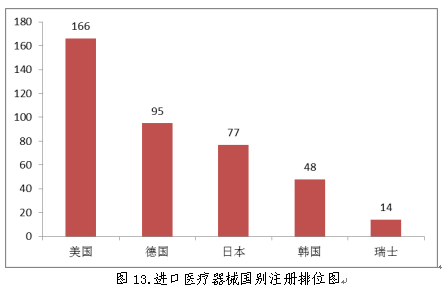
(五)进口医疗器械国别情况
2018年,美国、德国、日本、韩国和瑞士医疗器械在中国医疗器械进口产品首次注册数量排前五位,注册产品数量约占2018年进口产品首次注册总数量的75.6%,与2017年相比略有增加。
(六)境内第三类医疗器械省份分析
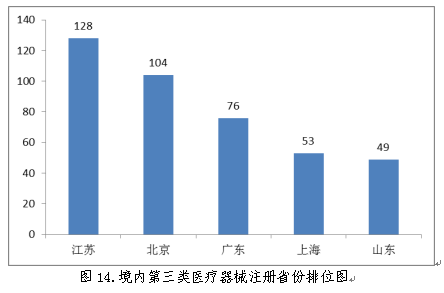
从2018年境内第三类医疗器械注册情况看,相关注册产品生产企业主要集中在沿海经济较发达省份。其中,北京、江苏、广东、上海、浙江是境内第三类医疗器械首次注册数量排前五名的省份,占2018年境内第三类医疗器械首次注册数量的68.4%,与2017年相比略有增加。
四、创新医疗器械等产品注册审批情况
2018年,国家药品监督管理局按照《创新医疗器械特别审查程序》,继续做好创新医疗器械审查工作,并批准了部分创新医疗器械产品上市。
2018年,国家药品监督管理局共收到创新医疗器械特别审批申请316项,完成310项审查(含2017年申请事项),确定45个产品进入创新医疗器械特别审批通道。批准21项创新医疗器械产品上市。其中,有源医疗器械7项,无源医疗器械5项,体外诊断试剂9项,与2017相比总数增加8项。
五、其他注册管理情况
(一)境内第二类医疗器械注册审批情况
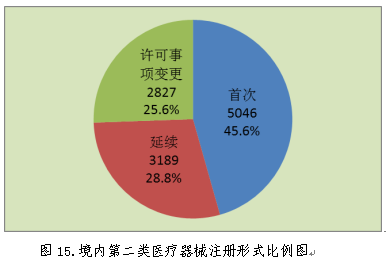
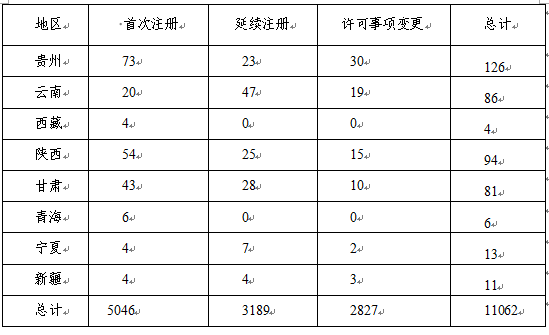
2018年,各省级药品监管部门共批准境内第二类医疗器械注册11062项,与2017年相比减少40.5%。其中首次注册5046项,占全部境内第二类医疗器械注册数量的45.6%;延续注册3189项,占全部境内第二类医疗器械注册数量的28.8%;许可事项变更注册2827项,占全部境内第二类医疗器械注册数量的25.6%。境内第二类医疗器械分项注册情况见图15。
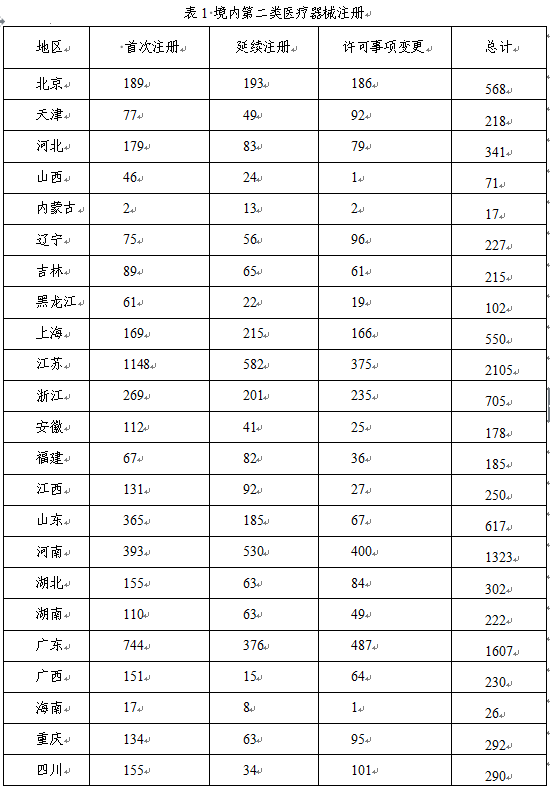
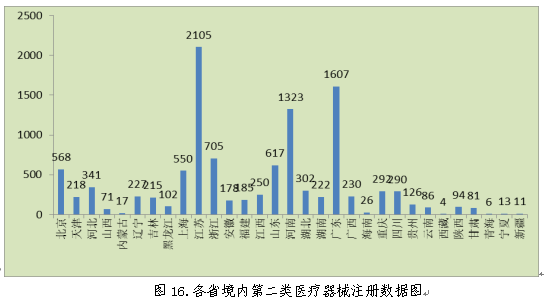
从注册情况看,江苏、广东、河南、浙江、山东、北京、上海七省(直辖市)注册的境内第二类医疗器械数量较多。第二类医疗器械注册具体数据见表1及图16。
(二)第一类医疗器械备案情况
2018年,国家药品监督管理局依职责共办理进口第一类医疗器械备案数量1744项,与2017年相比减少24.7%。全国设区的市级药品监管部门依职责共办理境内第一类医疗器械备案数量17177项,与2017年相比增长30.1%。
(三)登记事项变更情况
2018年,国家药品监督管理局依职责共办理进口第二、三类和境内第三类医疗器械登记事项变更7661项。与2017年相比增加47.9%。
其中,境内第三类医疗器械登记事项变更1598项,进口第二类、三类医疗器械登记事项变更6063项。
各省级药品监管部门依职责共办理境内第二类医疗器械登记事项变更6354项,与2017年相比增加0.4%。
注:本报告的数据统计自2018年1月1日至2018年12月31日。
【来源】国家药品监督管理局