2019年1月30日,国家药监局官网对12家境外医疗器械厂家生产现场检查结果进行了通报,这其中不乏富士、希森美康等国际大牌,生产质量管理规范或多或少都存在问题。也就是说,12家均被查出缺陷,没有一家是零缺陷!

就在此前1月18日,国家药监局公布《5家进口医疗器械境外生产现场检查结果》。明确表示:2018年,国家药品监督管理局组织对美国、德国、意大利等9个国家的26家进口医疗器械生产企业进行了境外生产现场检查,并于近日公布了吉卢比有限责任公司等5家企业的检查结果,其余厂家检查情况将陆续公布。而30日的检查结果就是后续公布内容。
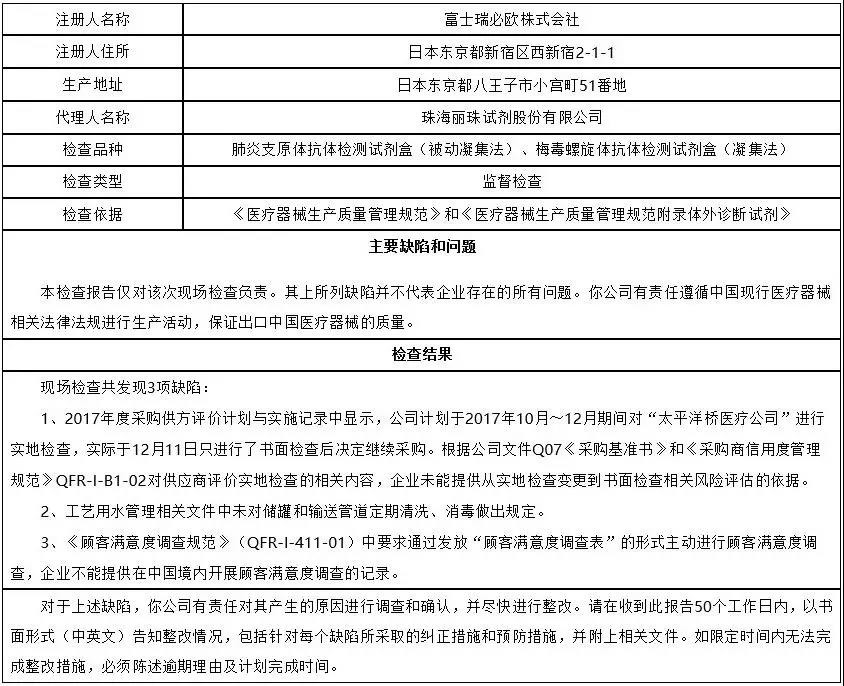
1、富士瑞必欧株式会社
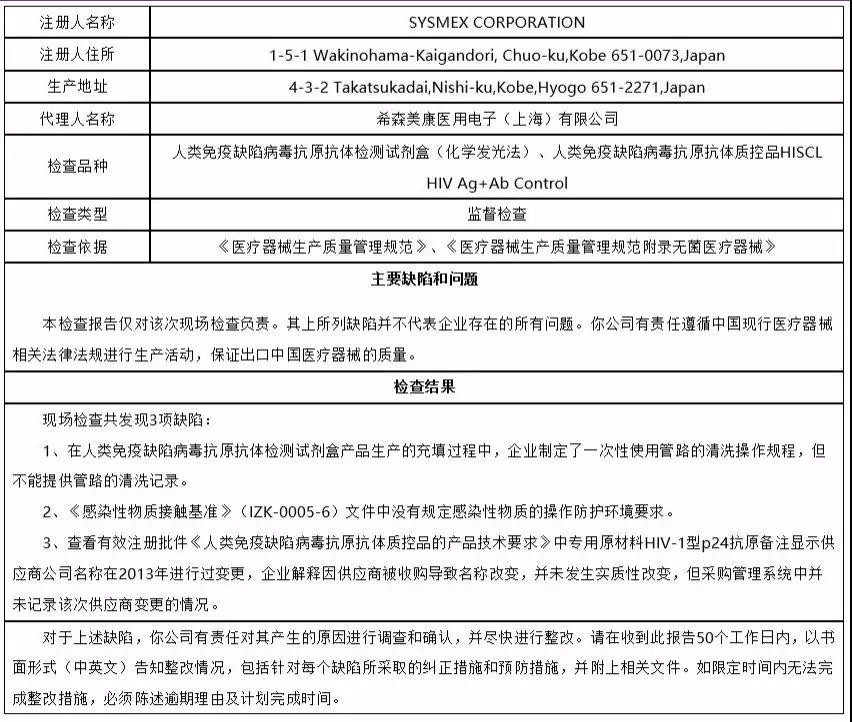
2、希森美康
3、贝朗爱敦

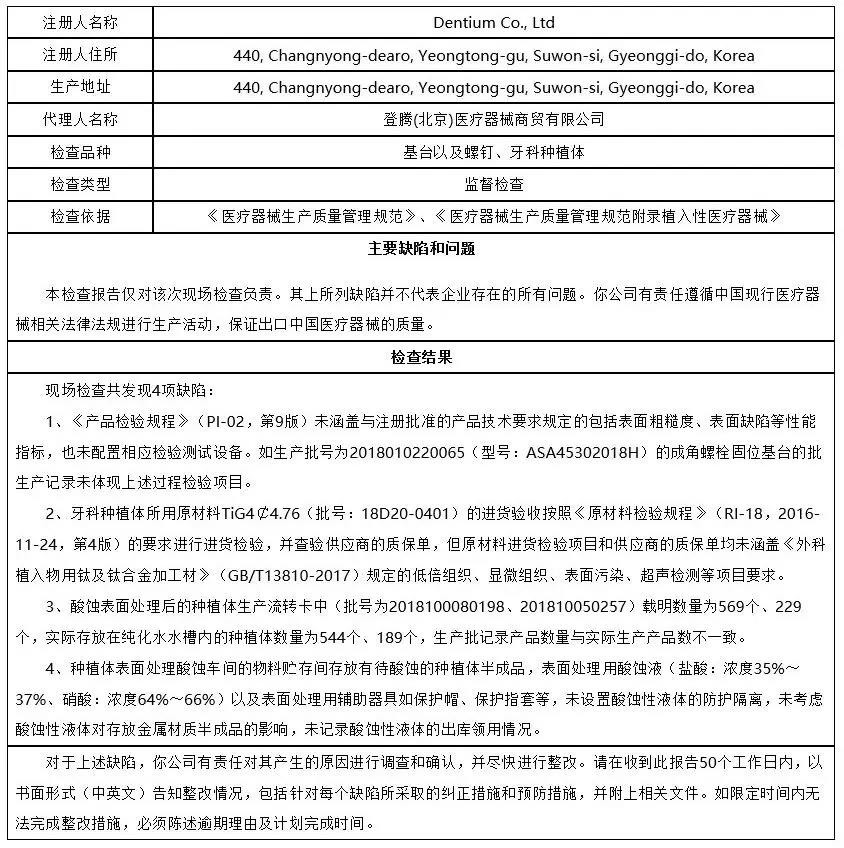
4、登腾医疗
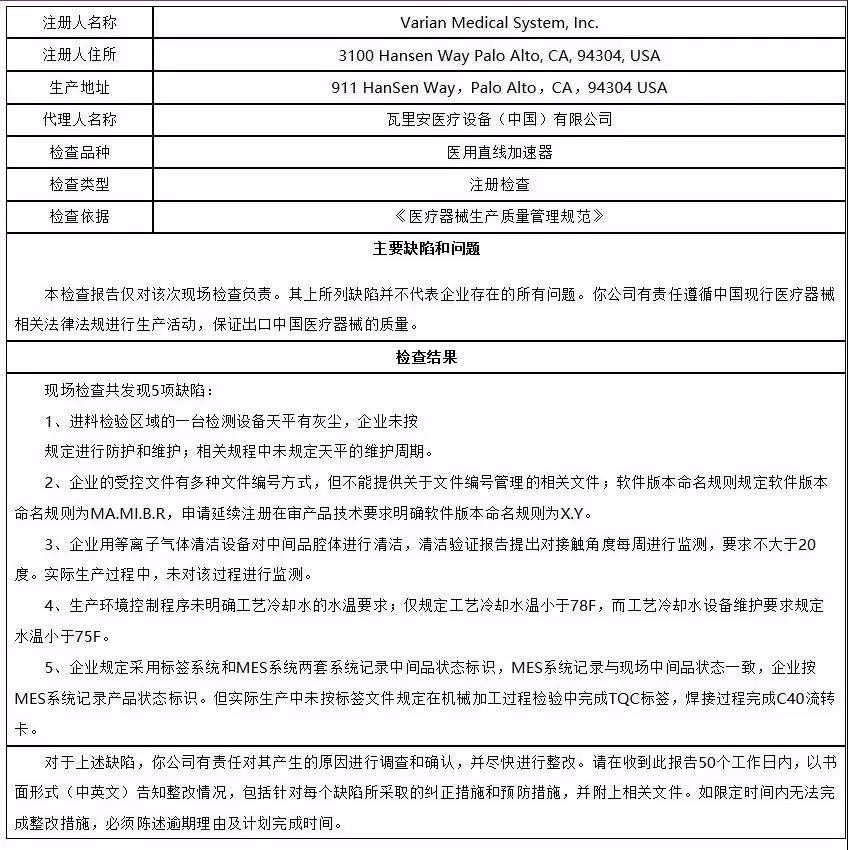
5、瓦里安医疗
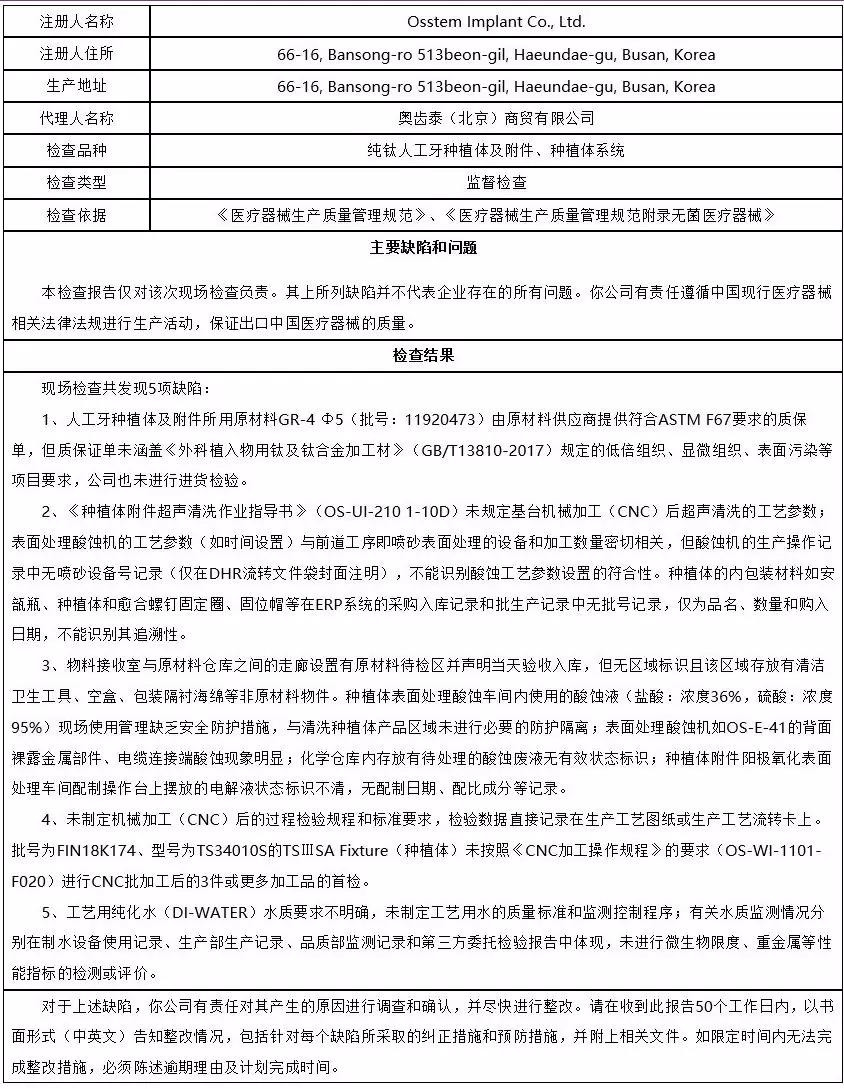
6、奥齿泰
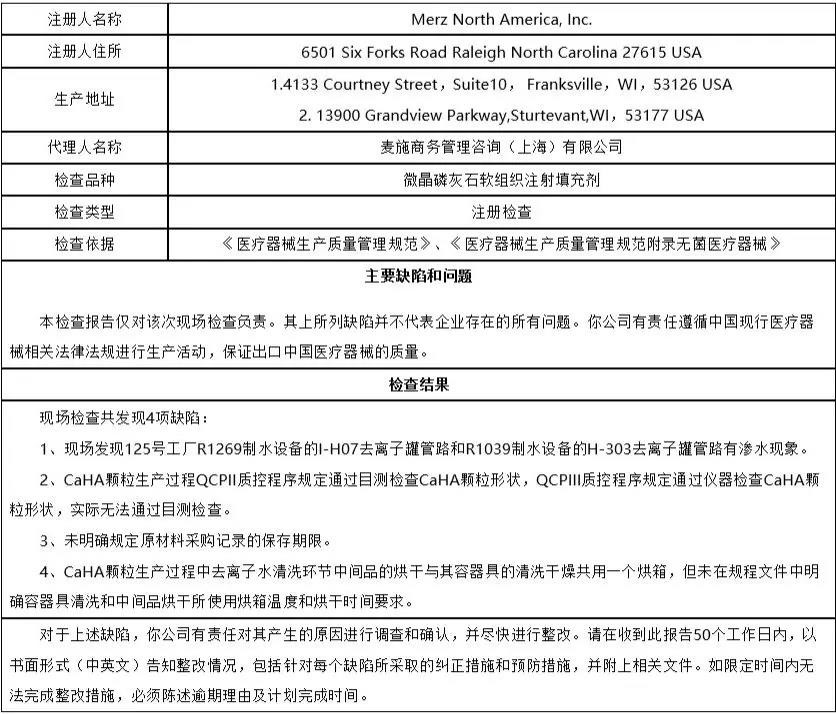
7、麦施
8、医美瑞医疗
9、波科国际医疗

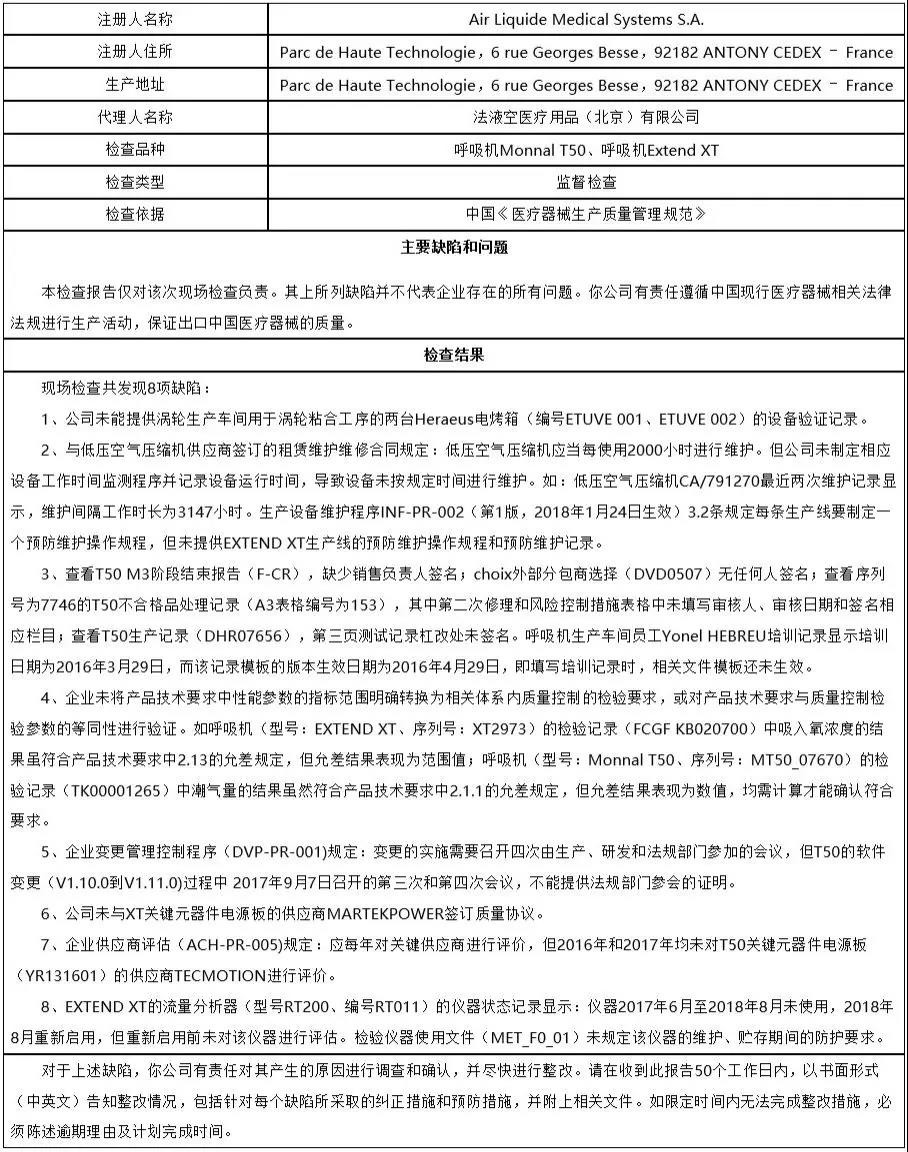
10、法液空医疗
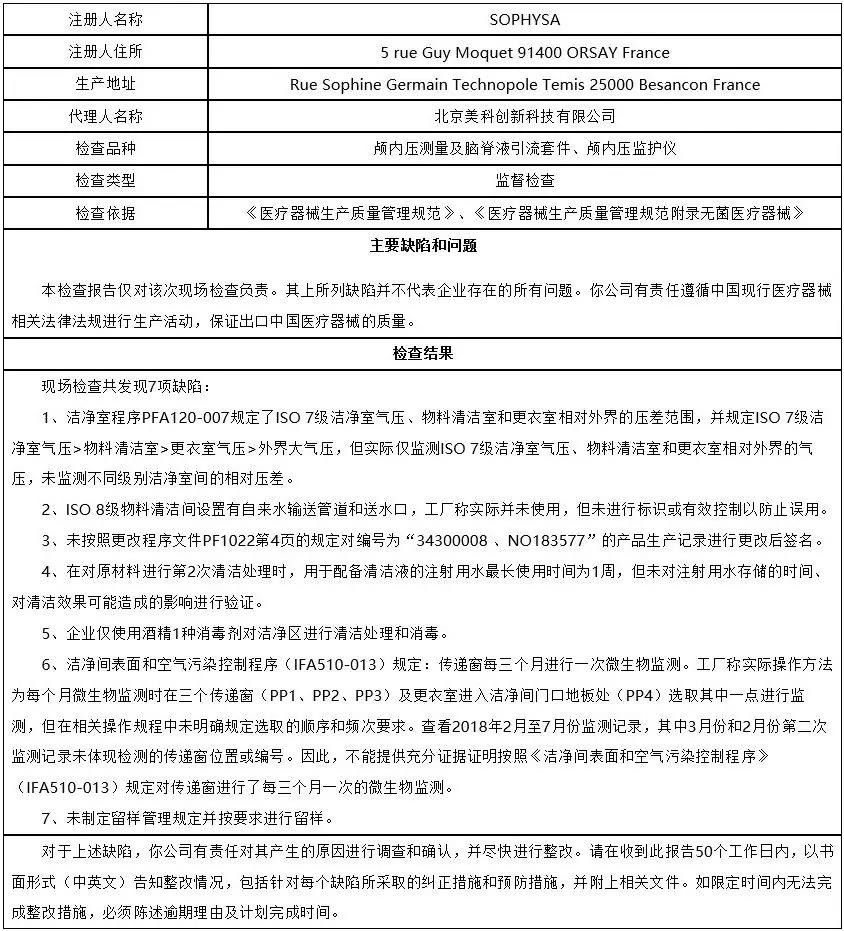
11、北京美科创新
12、世代保康
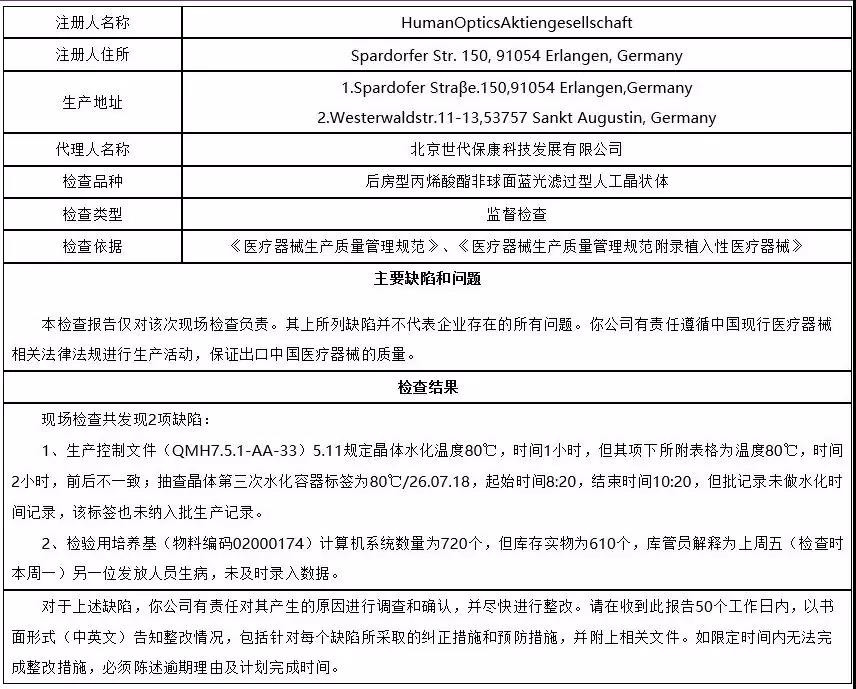
截止到2018年底,国家局已对71家境外医疗器械生产企业展开了现场检查。其中29家企业的检查结果已在官网通报。
早在2015年,药监总局就启动了对境外医疗器械生产企业的生产现场检查工作,强生和美敦力这两家全球医疗器械行业排名前两位的企业,被选择作为检查对象。
2016年,药监总局共对8个国家19家企业33个品种进行了生产现场检查。
2017年,药监总局共对10个国家24家企业的46个产品进行了生产现场检查,其中有6个还是在审产品。
而从本次发布的公告结果可知,2018年对境外械企的生产现场检查已经达到26家!境外检查力度越来越大!
飞检,是国家药监部门在新形势下全国范围内开展的日常监管方式之一,旨在核查医疗器械企业的生产质量管理是否完整,核查质量管理体系是否持续良好运行,及时发现企业存在的问题,找出日常生产中的薄弱环节,从而堵塞漏洞,防止质量事故的发生,保证医疗器械产品安全有效。
它有着行动隐秘、检查突然、接待灵活、即时记录等特点,就像上学时的突击测试:在不知时间、不知监考老师是谁、不知考题范围的情况下,校长进来突然通知你要考试。
对于企业来说,只有在日常生产和管理中从严要求自己,才能度过飞检这一关。
所以小编在这里也想温馨提示一下各位从事医疗器械生产和经营的朋友们,一定要在日常生产经营中严把质量关,要对自己对企业负责,更要对广大人民的健康负责!
整理:体外诊断网